
Reactions of xenon fluorides
 المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
 المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
 الجزء والصفحة:
443-444
الجزء والصفحة:
443-444
 2025-09-22
2025-09-22
 423
423
Reactions of xenon fluorides
Key points: Xenon fluorides are strong oxidizing agents and form complexes with, F such as XeF5, XeF7, and XeF8-2; they are used in the preparation of compounds containing Xe O and Xe N bonds. The reactions of the xenon fluorides are similar to those of the high oxidation state interhalogens (Section 17.10), and redox and metathesis reactions dominate. One important reaction of XeF6 is metathesis with oxides:
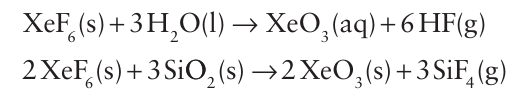
Another striking chemical property of the xenon fluorides is their strong oxidizing power:
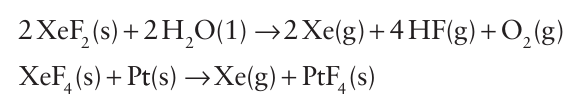
As with the interhalogens, the xenon fluorides react with strong Lewis acids to form xenon fluoride cations:
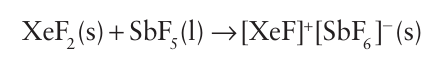
These cations are associated with the counterion by F bridges. Another similarity with the interhalogens is the reaction of XeF4 with the Lewis base F in acetonitrile (cyan methane, CH3CN) solution to produce the XeF5- ion:
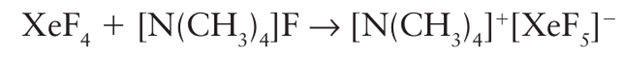
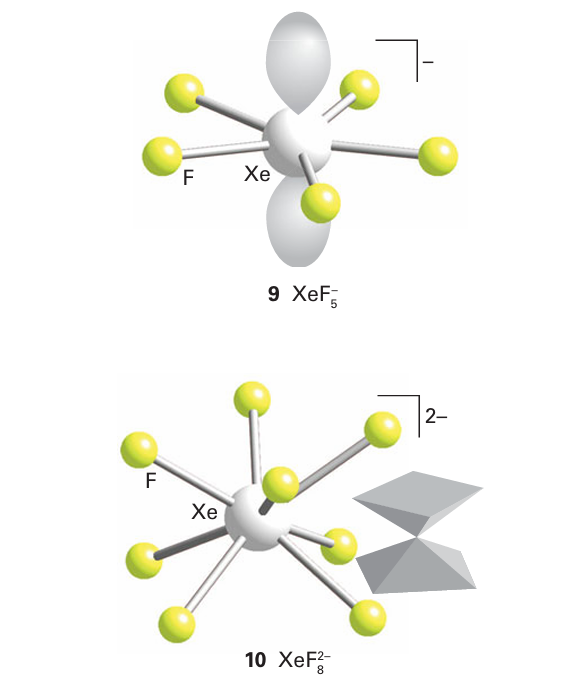
The XeF5 ion is pentagonal planar (9), and in the VSEPR model the two electron pairs on Xe occupy axial positions on opposite sides of the plane. Similarly, it has been known for many years that reaction of XeF6 with an F source produces the XeF7 or XeF8 2 ions depending on the proportion of fluoride. Only the shape of XeF8-2 is known: it is a square antiprism (10), which is difficult to reconcile with the simple VSEPR model because this shape does not provide a site for the lone pair on Xe.
The xenon fluorides are the gateway to the preparation of compounds of the noble gases with elements other than F and O. The reaction of nucleophiles with a xenon fluoride is one useful strategy for the synthesis of such bonds. For instance, the reaction.
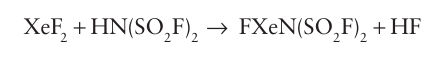
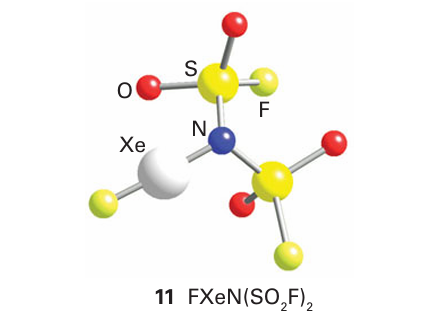
is driven forward by the stability of the product HF and the energy of formation of the Xe N bond (11). A strong Lewis acid such as AsF5 can extract F from the product of this reaction to yield the cation [XeN (SO2F)2]. Another route to XeN bonds is the reaction of one of the fluorides with a strong Lewis acid:
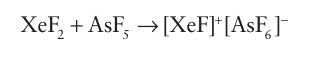
followed by the introduction of a Lewis base, such as CH3CN, to yield [CH3CNXe] + [AsF6].
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


