
قاعدة الطور لنظام ثلاثي المكون من الماء والكحول والأستر
 المؤلف:
الإدارة العامة لتصميم المناهج
المؤلف:
الإدارة العامة لتصميم المناهج
 المصدر:
أساسيات الكيمياء الفيزيائية (عملي)
المصدر:
أساسيات الكيمياء الفيزيائية (عملي)
 الجزء والصفحة:
ص62-63
الجزء والصفحة:
ص62-63
 2025-01-28
2025-01-28
 1006
1006
نظرية التجربة: يكون الماء مع الأستر نظاماً محدوداً الذوبانية ولكن تزداد الذوبانية عند إضافة سائل آخر مثل الكحول الايثيلي والذي يذوب بغير حدود في كل من السائلين الماء) أو (الأستر) ويعرف تمام الذوبانية باختفاء العكارة وتكون طبقه واحدة متجانسة وقاعدة الطور في حالة نظام مكثف وعند ثبوت درجة الحرارة تكون: F=C-P حيث F هي عدد المتغيرات المستقلة، P عدد الأطوار، C عدد المكونات. ولتمثيل قاعدة الطور لهذا النظام الثلاثي نحتاج إلى رسم مثلث متساوي الأضلاع (10سم لكل ضلع) يمثل كل ضلع أحد التركيزات وحيث يكون رأس المثلث ممثلاً لتركيز 100٪ من أحد المكونات ولأي نقطة في المثلث النقطة (P) فإن
Pa +Pb +Pc=100% حيث Pa يمثل نسبة الكحول ،Pb نسبة الأستر . Pcنسبة الماء. ولتمثيل النقطة (60% كحول، ماء30% %, أستر10)، خطاً بيانياً نرسم أولاً خطاً موازياً لمحور الأستر وعند تركيز كحول 60% (P) ثم نرسم . موازياً لمحور الكحول وعند تركيز ماء (Pb) 30% ، ثم أخيراً يكون الخط (Pa) موازياً لمحور الماء وعند 10 % أستر، وعندما نعين نقطة اختفاء العكارة عند تركيزات مختلفة نحصل على المنحنى الذي يصف قاعدة الطور والمسمى بالمنحنى ثنائي العقدة.
المواد المستخدمة:
كحول إيثيلي أستر خلات الإيثيل، ماء مقطر.
الأدوات المستخدمة:
5 دوارق صغيرة ( 100 مل). ماصة سعة 10 مل سحاحة.
خطوات العمل:
- اخلط في الخمس دوارق الحجوم التالية (مل)
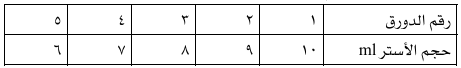

2- ضف باستخدام السحاحة الكحول قطرة حتى تبدأ العكارة في الاختفاء ثم قم بتسجيل حجم الكحول في كل حالة.
3- احسب النسبة المئوية لمكونات كل دورق عند تمام الامتزاج (W/W): المكون% = ((وزن المكون) + ) وزن كل المكونات) × 100
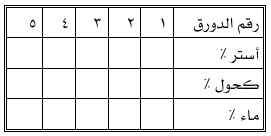
علماً بأن كثافة الماء المقطر = 0.996 جم / مل. كثافة الأستر = 0.894جم م / مل. كثافة الكحول = 0.789 جم / مل.
ارسم النتائج على المثلث المتساوي الأضلاع المنحنى ثنائي العقدة وأوجد النهاية العظمى للذوبانية (التركيزات المقابلة).
 الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


